기존보다 약 900배 정도 향상된 결합력을 얻어 암세포의 효과적인 사멸 효과 확인

암을 부작용 없이 효과적으로 치료하기 위해서는 약물을 암세포에 특이적으로 전달할 수 있는 기술이 필요하다. 단백질로 구성되어 있는 단백질 조립체는 암 치료를 위한 약물 전달에 널리 활용되고 있다.
단백질 조립체를 약물 전달에 이용하기 위해서는 암세포를 인식하는 단백질과 암세포를 사멸시키는 약물을 단백질 조립체에 효과적으로 접합시키는 기술, 즉 기능화(functionalization) 기술이 필수적이다. 그러나, 단백질 조립체의 경우 기능화 과정이 매우 복잡하고, 효율이 낮으며, 대부분 작은 크기의 화학 약물(chemical drug)의 적용에만 한정되어 실제 사용에 많은 제약이 있었다.
KAIST는 생명과학과 김학성 교수 연구팀이 암세포에 특이적으로 약물을 전달할 수 있는 클라트린 조립체를 개발했다고 14일 밝혔다.

생체 내 클라트린이라는 단백질 조립체는 세포 안에서 자가조립(self-assembly)되어 물질을 효율적으로 수송(endocytosis)한다. 클라트린 조립체는 먼저 3개의 중쇄(heavy chain)와 3개의 경쇄(light chain)가 결합하여 트리스켈리온(triskelion)이 만들어지고, 이후 트리스켈리온이 자가조립 되어 형성된다. 연구팀은 이에 착안하여, 암세포에 특이적으로 약물을 전달하기 위해 암세포 인식 단백질과 독소 단백질의 기능화가 용이하도록 클라트린 사슬을 설계하였고, 이를 이용하여 새로운 형태의 클라트린 조립체(clathrin assembly)를 얻었다.
개발된 클라트린 조립체는 원 포트 반응(one-pot reaction)으로 두 종류의 단백질(암세포 인식 단백질과 독소 단백질)을 동시에 높은 효율로 접합시킬 수 있어, 향후 약물 전달, 백신 개발 및 질병 진단 등을 포함한 생물 의학 분야에서 광범위하게 활용될 수 있을 것으로 기대된다.
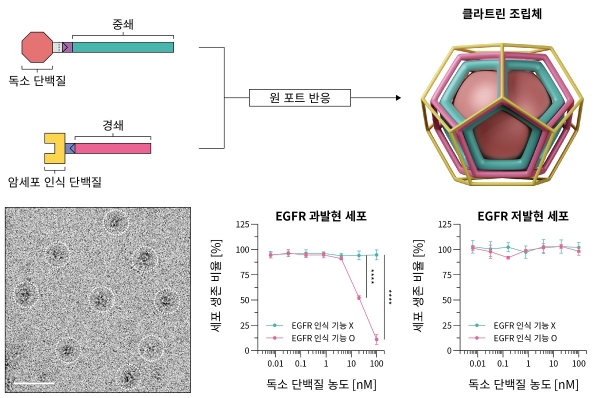
이번 연구에서는 대표적인 종양 표지자인 상피세포성장인자수용체(EGFR)를 인식하는 단백질을 사용하여, 암세포에 특이적으로 약물을 전달할 수 있었다. EGFR을 인식하는 단백질로 기능화된 클라트린 조립체는 결합증대 효과(avidity effect)로 인해, 기존보다 무려 900배 이상 향상된 결합력을 보였다. 연구팀은 이를 기반으로, 독소 단백질을 연결한 클라트린 조립체를 세포에 처리했을 때, 정상 세포에는 영향이 없으나 암세포만 효과적으로 사멸시킨다는 것을 확인했다.
KAIST 생명과학과 김홍식 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `스몰(Small)'에 지난 2월 22일자 19권 8호에 출판됐으며, 표지 논문으로 선정됐다.

제1 저자인 김홍식 박사는 "클라트린은 기능화가 어렵고 포유류의 세포로부터 추출해서 얻었기 때문에 실질적인 적용이 제한되었다”라며 “이번 연구에서 새로 설계한 클라트린 조립체는 한 번의 반응으로 서로 다른 두 종류의 단백질로 기능화할 수 있고, 대장균에서 생산 가능하여, 생물 의학 분야에서 광범위하게 활용될 수 있는 단백질 조립체 응용 기술이 될 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 글로벌박사양성사업과 중견연구자지원사업의 지원을 받아 수행됐다.



